मूलद्रव्य व त्यांचे गुणधर्म – भाग २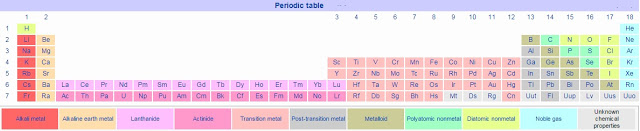 हायड्रोजन
हायड्रोजन
हायड्रोजन अणुक्रमांक : १
शोध:-
०१. H2 स्वरूपातील हायड्रोजन वायू पॅरासेल्सस ह्या स्विस अल्केमिस्टने
प्रथम तयार केला. त्याने धातू आणि तीव्र आम्ल ह्यांच्या प्रक्रियेमधून हा ज्वलनशील वायू तयार केला. त्याला त्या वेळेस हायड्रोजन हे एक रासायनिक मूलद्रव्य आहे ह्याची कल्पना नव्हती.
०२. १६७१ मध्ये रॉबर्ट बॉइल ह्या आयरिश रसायनशास्त्रज्ञाने हायड्रोजनचा पुन्हा शोध लावला व सौम्य आम्ल आणि लोखंडाच्या चूर्णाच्या प्रक्रियेतून हायड्रोजन वायूच्या उत्पादनाचा तपशील दिला.
०३. १७६६ मध्ये हेन्री कॅव्हेंडिश ह्या ब्रिटिश शास्त्रज्ञाने हायड्रोजनला एक स्वतंत्र पदार्थ म्हणून मान्यता दिली.
-धातू आणि आम्ल यांच्या प्रक्रियेतून निर्माण होणाऱ्या या वायूस त्याने “ज्वलनशील हवा” असे नाव दिले आणि ह्या वायूच्या ज्वलनातून पाणी तयार होते हे त्याने शोधले.
-अर्थात त्याने हायड्रोजन हा आम्लामधून मुक्त झालेला नसून पाऱ्यामधून मुक्त झालेला घटक आहे असा चुकीचा निष्कर्ष काढला. पण हायड्रोजनच्या अनेक कळीच्या गुणधर्मांचे त्याने अचूक वर्णन दिले.
-असे असले तरी, मूलद्रव्य म्हणून हायड्रोजनचा शोध लावण्याचे श्रेय सर्वसाधारणपणे त्यालाच दिले जाते.
०४. १७८३ मध्ये आंत्वॉन लवॉसिए ह्या फ्रेंच रसायनशास्त्रज्ञाने या वायूच्या ज्वलनामुळे पाणी तयार होते, म्हणून त्या वायूला हायड्रोजन असे नाव दिले.
-हायड्रोजनच्या नावाची उत्पत्ती-प्राचीन ग्रीक भाषेतील हायडॉर म्हणजे पाणी, तर जेनेस म्हणजे तयार करणे या शब्दांच्या संयोगातून झाली आहे.
-हायड्रोजनच्या ज्वलनातून पाणी तयार होते म्हणून ‘पाणी तयार करणारा’ अर्थात ‘हायड्रोजन’ असे त्याचे नामकरण केले.
०५. हायड्रोजनचे औद्योगिकरीत्या उत्पादन मिथेनसारख्या कर्बोदकापासून केले जाते.
-इलेक्ट्रॉलिसिस पद्धतीने पाण्यापासूनही हायड्रोजन तयार करता येतो, पण नैसर्गिक वायूपासून हायड्रोजन मिळवण्यापेक्षा ही पद्धत खूपच जास्त महाग पडते.
०६. हायड्रोजन हे खनिज तेलापेक्षा ऊर्जा निर्मितीच्या बाबतीत सर्वात कार्यक्षम इंधन ठरते. पेट्रोल दर लिटरमध्ये ४२००० बी. टी. यु.(ब्रिटिश थर्मल युनिट) तर द्रव हायड्रोजन दर लिटरला १,३४,५०० बी. टी. यु. एवढी उष्णता निर्माण करतो.
-परंतु याच्या निर्मितीचा खर्च परवडत नसल्यामुळे हायड्रोजन हे प्रचलित साधन होण्यात अडचण येत आहे.
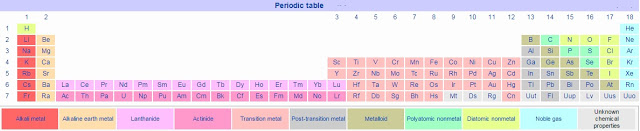
०७. गुणधर्म :- हायड्रोजन H ह्या चिन्हाने दर्शवितात. सामान्य तापमानाला आणि दाबाला हायड्रोजन वायुरूपात असतो. हायड्रोजन हा रंगहीन, गंधहीन, चवरहित व अतिशय ज्वलनशील वायू आहे.
-स्थिर स्वरूपात असताना हायड्रोजन रेणू प्रत्येकी २ अणूंनी बनलेले असतात. हायड्रोजन हे सर्वांत हलके मूलद्रव्य आहे. विश्वात आढळणाऱ्या सर्व पदार्थांच्या वजनापैकी ७५ टक्के वजन हायड्रोजनचे आहे.
०८. हे विश्वात सर्वाधिक आढळणारे मूलद्रव्य आहे. विश्वातील बहुतेक ताऱ्यांमध्ये मुख्यत्वे हायड्रोजन हेच मूलद्रव्य प्लाज्मा या स्वरूपात सापडते. पृथ्वीवर हायड्रोजन क्वचित मूलद्रव्य स्वरूपात आढळतो.
०९. हवेमध्ये हायड्रोजन अतिशय जलदपणे पेट घेऊ शकतो. ६ मे १९३७ रोजी हिंडेनबर्ग अपघात त्यातील हायड्रोजनने जलद पेट घेतल्याने झाला.
2H2(g) + O2(g) → 2H2O(l) + ५७२ किलोजूल (२८६ किलोजूल/मोल)१०. हायड्रोजन वायू संक्रमणी धातूंमध्ये व विरळा मृद्धातूंमधे अतिशय सहज विरघळू शकतो.
-तसेच तो स्फटिक धातूंमधे व अस्फटिक धातूंमध्येही विरघळतो. हायड्रोजनची विरघळण्याची क्षमता ह्या धातूंच्या स्फटिकांच्या स्थानिक विकृती आणि अशुद्धतेमुळे वाढते.
११. प्राणवायू बरोबर वेगवेगळ्या प्रमाणात मिसळून पेटवला असता हायड्रोजनचा स्फोट होतो. हवेमध्ये तो अतिशय जोरदार पेटतो.
-हायड्रोजन-प्राणवायूच्या ज्वाला अतिनील ऊर्जालहरी असतात आणि त्या साध्या डोळ्यांना जवळजवळ अदृश्य असतात. त्यामुळे हायड्रोजनची गळती आणि ज्वलन नुसते बघून ओळखणे अवघड असते.
१२. हायड्रोजनच्या ज्वलनाचे आणखी एक वैशिष्ट्य म्हणजे त्याच्या ज्वाला अतिशय जलदपणे हवेत वर जातात, त्यामुळे हायड्रोकार्बनच्या आगीपेक्षा त्यातून कमी नुकसान होते.
-म्हणूनच हिंडेनबर्ग अपघातातील दोन-तृतीयांश लोक हायड्रोजनच्या आगीतून वाचले.
* हेलियम
०१. हेलियम हा एक रंगहीन, गंधहीन, चवरहीत, बिनविषारी, उदासीन वायू आहे. हेलियम हे २ अणूक्रमांकाचे रासायनिक मूलद्रव्य आहे.
* बेरिलियम
०४. बेरिलियमचे ज्वलन होतांना दर कि. ग्रॅ. ला १५,००० किलोकॅलरी एवढी प्रचंड उष्णता बाहेर पडते म्हणून पृथ्वीबाहेर होणाऱ्या अवकाश उड्डाणात एक अत्यंत कार्यक्षम इंधन म्हणूनही बेरिलियमचा उपयोग करण्याच्या दृष्टीने विचार होत आहेत.
०५. अति हलक्या धातूंपैकी एक असूनही बेरिलियम उत्कृष्ट ताकदीचे आहे. शिवाय मॅग्नेशियम, अॅल्युमिनियम यांच्या पेक्षाही त्याचा उकळणबिंदू जास्त वरचा आहे.
-या कारणाने विमानात वापरले जाणारे १,००० पेक्षाही जास्त सुटे भाग हे बेरिलियम-ब्राँझ पासुन बनविलेले असतात.
०७. या मिश्रधातूचा उपयोग काही हत्यारे बनविण्यासाठीही होतो व त्यांचा वापर स्फोट होऊ शकेल अशा ठिकाणी केला जातो. कारण या मिश्रधातूच्या आपटण्याने कोणत्याही प्रकारची ठिणगी निघत नाही.
-बेरिलियम- मॅग्नेशियम, बेरिलियम-लिथियम ही संयुगेही मोठ्या प्रमाणात वापरली जातात.
०८. बेरिलियमच्या अनेक खनिजांपैकी पाचू , बेरूज, हेलियोडोर, वैडूर्य , फेनाकाइट, युक्लेज, हेमवैदूर्य , व्हेरोबायेव्हाइट आणि अॅलेझांड्राइट असे काही विशेष गाजलेले खनिज पदार्थ आहेत.
-यापैकी हिरव्या एमराल्डची चमक, रंगाची शुद्धता, काळीशार वाटणारी गडद हिरव्या रंगापासून ते नेत्रदीपक चमचमत्या मोरपंखी रंगाचे अनेक प्रकार कित्येक शतकांपासून मानवाला भुरळ घालत आले आहेत.
-तर अॅलेझांड्राइट हा विस्मयजनक प्रकार असून तो दिवसा गर्द हिरव्या रंगाचा असतो तर हा रात्रीच्या कृत्रिम प्रकाशात किरमिजी रंगात दिसतो.